Девочка и лекарство
Калифорнийская девочка Зое Хартинг родилась в октябре 2012 года. Поначалу она казалась вполне здоровой, но через несколько недель родители заметили, что она намного слабее своей двоюродной сестры, которая родилась на неделю позже. Вскоре педиатры подтвердили опасения родителей. В возрасте полугода девочка не могла двигать ножками, не могла поднять руки, ей было трудно глотать. Врачи предупредили родителей, что вскоре ей станет трудно дышать. Их прогноз был ужасен: Зое была обречена умереть на втором году жизни. У нее была самая тяжелая форма т.н. спинальной мышечной атрофии (СМА). Атрофия эта называется «спинальной», потому что поражает двигательные нейроны спинного мозга, вызывая нарушение работы мышц ног, шеи и головы, иногда также рук, а в тяжелой форме – и дыхательного горла. Поэтому 50% детей с такой формой СМА не доживают до 2 лет.
Ученые давно изучают болезнь СМА. И им удалось установить, что она вызвана порчей определенного гена. Такой испортившийся ген встречается сегодня у каждого 50-го человека, т.е. у 2% всех людей. Но сам по себе он не опасен. Он вызывает болезнь лишь в том случае, если ребенок получает этот испорченный ген сразу от обоих родителей. Встреча двух таких родителей довольно маловероятна, поэтому болезнь поражает лишь одного из каждых 6-10 тысяч детей. Однако все эти вероятности ничего не стоят, когда заболевает именно твой ребенок, и поэтому родители Зое Хартиг начали немедленно выяснять, не проводятся ли где-нибудь клинические испытания потенциальных лекарств от страшного недуга.
Длинная цепочка звонков в конце концов привела их к доктору Джону Дэю из Стэнфорда. Доктор Дэй входил в одну из четырех исследовательских групп, которые как раз в это время проводили клинические испытания нового экспериментального препарата «Нузинерсен», предназначенного именно для лечения СМА. Проверка уже прошла первый этап: препарат был проверен на детях более старшего возраста, страдавших слабой формой СМА, и показал обнадеживающие результаты. Теперь врачи хотели перейти ко второму этапу проверки - на грудных детях с тяжелой формой болезни, и доктор Дэй, узнав о состоянии Зое, предложил Джону и Элизе Хартиг испробовать новое лекарство на их обреченной девочке. Так получилось, что в июне 2013 года 7-месячная Зое стала первым в мире ребенком, в чей спинной мозг был введен препарат, на который врачи возлагали большие надежды.
Чтобы объяснить, на чем основывались эти надежды, мне придется сделать некое отступление. Если хотите, можете смело пропустить его и перейти сразу к счастливому концу. Если же хотите узнать кое-что о великолепной сложности нашего организма и о том. как ученые постигают и даже дерзают «слегка поправить» эту сложность, то вперед, за мной.
Вы, конечно, знаете, что вся наша наследственность упрятана в генах. В ядре каждой нашей клетки находится набор особых молекул, т.н. ДНК, и отдельные их участки несут на себе программы построения тех или иных белков; эти участки и называются генами. Молекулы ДНК укутаны для защиты в особые белки и в таком виде называются хромосомами. Таких хромосом у человека 23 пары (в каждой паре одна отцовская, одна материнская), и они отличаются друг от друга по длине (и, разумеется, по функциям), поэтому ученые для удобства их нумеруют.
Интересующий нас ген болезни СМА находится на хромосоме номер 5, Она одна из самых больших, хотя генов на ней (относительно ее длины) почему-то мало, порядка 900-1300 штук. Один из них, под названием SMN1, несет в себе программу для производства белка SMN, что можно расшифровать по-русски, как «спаситель моторного нейрона» (по-английски это S означает survival, выживание). Этот белок чрезвычайно важен для нормальной работы двигательных нейронов спинного мозга. Если в организме его недостаточно, эти нейроны со временем гибнут и человек теряет способность производить необходимые для жизни движения, вплоть до дыхания.
Поскольку хромосомы живут парами, то у каждого человека два таких гена, так что даже если один окажется испорченным, моторные нейроны будут защищены белком второго. Но если оба гена у человека испорчены, болезни не миновать. Ученые нашли также в чем, собственно, состоит эта «порча». Многие гены, как показали исследования, состоят из нескольких рабочих участков, т.н «эксонов», разделенных нерабочими «интронами». Так сложилось в ходе эволюции, когда какие-то более или менее безвредные бактерии или вирусы, попав в чужой организм, встраивали куски своих ДНК в хромосомы этого организма. Для построения белка важны только эксоны данного гена, именно они составляют программу его построения. Ген SMN1 имеет 9 эксонов. Но у некоторых людей в этом гене есть мутация, из-за которой участок номер 7 либо вообще отсутствует, либо не работает. Белок, сделанный по такой укороченной программе, не может выполнять свою функцию моторных нейронов. Он вообще ничего не способен делать и быстро распадается.
Казалось бы, все такие люди должны гибнуть в раннем возрасте. Между тем врачебная практика показывает, что даже если у человека испорчены оба гена SMN1, болезнь СМА может поразить его в самом разном возрасте, от грудного до старческого, и иметь разную степень тяжести (ученые нумеруют эту степень тяжести от 0 до 5, а врачи имеют для каждой свое название - атрофия Верднига-Хоффмана, атрофия Дубровица и т.д.). Подмечено также, что чем раньше начинается болезнь, тем тяжелее ее последствия - например, дети с атрофией Верднига-Хоффмана (именно она была диагностирована у Зое Хартинг) в 50% случаев не доживают до 2 лет.
Как же получается, что человек, родившийся с двумя испорченными копиями гена, иногда заболевает только в старости, а другой такой же человек умирает в грудном возрасте? Эта загадка потребовала многих новых исследований, но в конце концов тоже была разгадана. Выяснилось, что в том же районе 5-й хромосомы, где расположен ген SMN1, имеется еще один (или даже несколько) его «почти-двойников». Этим генам дали название SMN2. Они во всем похожи на здоровый SMN1, но имеют одно отличие - злополучный 7-й эксон попадает в их белок только при каких-то особых условиях или лишь в тех или иных тканях, проще говоря – далеко не всегда. Детальное изучение показало, что всего 10-20% белковых молекул, производимых по программе генов SMN2, оказываются нормальными и «спасают» моторные нейроны, а остальные 80-90% не имеют 7-го участка и быстро распадаются. Теперь понятно, что время начала болезни (и ее тяжесть) напрямую зависят от количества нормального белка SMN, которое могут дать организму эти «почти-двойники». У некоторых людей таких «почти-двойников» 2, 3 и даже 4 (потому что мутация в гене SMN1 в некоторых случаях превращает его в SMN2), и у них болезнь проявляется лишь в зрелом возрасте и ее симптомы легче, а у других, как в случае Зое Хартиг, оба гена SMN1 не работают вообще, а гены SMN2 , если и есть, производят так мало нормального белка, что болезнь начинается уже с рождения.
Как же лечить таких детей? Если вы заглянете на русский сайт «Спинальная мышечная атрофия», вы прочтете там: «Радикального лечения не существует». Но это не совсем так. В действительности сама природа в своей утонченной сложности подсказала ученым некий возможный путь. В самом деле, почему 7-й эксон иногда попадает в белок гена SMN2, а иногда не попадает? Нельзя ли сделать, чтобы он попадал всегда или хотя бы чаще?
Ответ на этот вопрос требует выяснения, на каком этапе происходит эта развилка: «попадает – не попадает». Очередные исследования показали, что она происходит на втором этапе производства белка. Этот этап состоит в том. что некий белковый комплекс, двигаясь по гену, строит рядом с ним его зеркальную копию; эта молекула-копия называется РНК. Она должна перенести программу построения белка от гена в то место, где по этой программе будет построен белок. Понятно, что эта РНК, будучи зеркальным отражением всего гена, неизбежно содержит в себе как копии эксонов, так и копии интронов. Но как уже сказано, интроны для построения белка не нужны, и природа создала второй специальный комплекс белков, который, тотчас садится на эту «исходную РНК» и ползет по ней, по пути вырезая все интроны и «сшивая» внахлест эксоны. В конце его работы из исходной РНК образуется более короткая «рабочая РНК», которая содержит только программу построения белка, без всяких интронов. Эта операция «укорочения» РНК называется по-английски «спляйсинг», или «сращивание эксонов.
И вот, присмотревшись к этой операции, ученые обнаружили важную, ранее неизвестную деталь. Оказалось, что к эксонам исходной РНК сразу после ее образования присоединяются некие белковые «пометки» двух видов - «усилители» или «глушители». Когда сшивающий комплекс доходит до метки-«глушителя», она побуждает его вырезать этот эксон (как будто он интрон). А метка-«усилитель», понятно, действует обратным путем. Таким образом, спляйсинг оказывается альтернативным: эксон или попадает в рабочую РНК, или не попадает. И вот беда: в исходной РНК, скопированной с гена SMN2 , на 7-м эксоне в 80-90% случаев появляется метка-«глушитель», и комплекс вырезает этот эксон, так что в результате рабочая РНК его не содержит и ее белок оказывается испорченным. А в 10-20% случаев 7-й эксон не вырезается, так что и рабочая РНК, и ее белок оказываются нормальными.
Сразу видно, что сама природа подсказывает здесь заманчивую возможность: устранить каким-нибудь путем метку-«глушитель» 7-го эксона со всех РНК, где она есть, и тогда все «почти-двойники» будут давать нормальный белок SMN. Можно ли это сделать практически? Ученые в разных странах мира ищут пути к этому, и создатели нузинерсена первыми нашли способ искусственного синтеза такой молекулы, которая способна садиться на 7-й эксон исходной РНК, тем самым не допуская туда белок «глушитель». Понятно, что не все такие молекулы, будучи введены в спинной мозг, достигают своих «мишеней», но, как показали уже первые опыты, заметная их часть все же попадает на нужные места, и это приводит к заметному увеличению производства нормального SMN с гена SMN2.
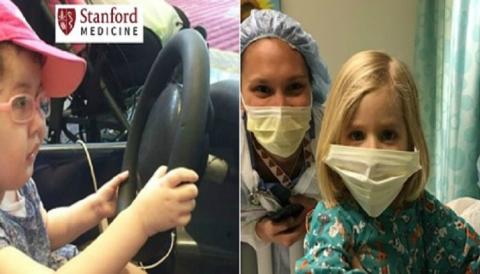
Зое Хартиг получила первую дозу нузинерсена в июне 2013 года. Затем эти инъекции повторялись каждые несколько месяцев. Первый год лечения был очень тяжелый. Она была очень слаба и поэтому часто простужалась и перенесла несколько пневмоний, которые почти сводили на-нет всё лечение. Но в конце своего второго года она начала явно набирать силы. Она уже могла, лежа на спине, поднимать ножки и играть со своими пальчиками. Вскоре затем она заговорила. Ей стало легче кашлять, и это помогло ей бороться с респираторными заболеваниями. Она обрела способность самостоятельно двигать головой, а потом окрепла настолько, что смогла сидеть (правда, с посторонней помощью).
Сегодня девочке 4 года. Она уже может самостоятельно есть, она говорит. Она может даже крикнуть, она увлеченно воюет со своей младшей сестричкой. Она научилась ездить на своей моторизованной коляске. Недавно родители купили ей лежачий велосипед, чтобы она могла развивать мышцы ног. Кто бы мог подумать!
В августе этого года фирмы «Ионис» и «Биоген», испытывавшие нузинерсен, прервали третий этап клинической проверки этого препарата, поскольку стало очевидным, что все грудные дети, получавшие это лекарство, обнаруживают явное улучшение моторных функций в сравнении с контрольной группой. Фирмы подали заявку на разрешение коммерческого использования этого препарата, обещав предоставлять его всем больным детям бесплатно и ограничиться лишь получением от страховых компаний возмещения расходов в размере от 10 до 50 тысяч за годичный курс лечения. Обращение формы было поддержано петицией, под которой подписались 124 тысячи родителей больных американских детей.
Рафаил Нудельман
"Окна", 22.12.2016